El logro se publicó en línea el 29 de enero en Informes sobre célulasLa investigación sobre la enfermedad de Alzheimer esporádica elimina un importante obstáculo para los científicos que tratan de determinar sus causas y encontrar fármacos que puedan prevenir o invertir sus devastadores efectos neurodegenerativos.
El trabajo también aporta información sobre los cambios moleculares tempranos que pueden conducir al Alzheimer y apunta a una posible diana terapéutica.
Se calcula que la enfermedad de Alzheimer afecta a 5,7 millones de personas en Estados Unidos. Hasta ahora, la mayoría de los modelos de "Alzheimer en un plato" procedían del Alzheimer familiar, una forma rara de la enfermedad que se da en familias, está causada por mutaciones genéticas dominantes y suele manifestarse antes de los 65 años.
En cambio, se cree que la forma esporádica se debe a una serie de factores de riesgo genéticos y ambientales que aún no se conocen del todo.
El nuevo modelo "es un intrigante sistema in vitro que se ha echado en falta en este campo", dijo el autor principal del estudio Bruce Yanknercatedrático de genética del Instituto Blavatnik del HMS, que en la década de 1990 dirigió el equipo que demostró por primera vez los efectos tóxicos de la beta amiloide, la característica distintiva del Alzheimer.
Utilizando su nuevo modelo, Yankner y sus colegas identificaron cambios en las células madre neurales durante el desarrollo temprano -incluida la diferenciación acelerada y las anomalías en una proteína que se cree que protege contra el deterioro cognitivo relacionado con la edad- que pueden aumentar la probabilidad de desarrollar Alzheimer más adelante en la vida.
"Es emocionante descubrir un fenotipo compartido", afirma Yankner. "Fue inesperado".
Divergencia dramática
Yankner y sus colegas empezaron por obtener células de la piel de cinco personas con Alzheimer esporádico y seis personas sanas de las mismas edades. Revertieron estas células adultas a un estado anterior indiferenciado. Estas células madre pluripotentes inducidas (iPS) pueden dar lugar a muchos otros tipos celulares.
Al principio, las células derivadas del Alzheimer y las de control parecían indistinguibles. Pero cuando el equipo las obligó a madurar hasta convertirse en progenitores neurales -células madre que dan lugar a la mayoría de los tipos celulares del cerebro- surgieron diferencias dramáticas.
Los análisis de ADN revelaron que las células de Alzheimer tenían una actividad inusualmente alta en genes relacionados con la diferenciación neuronal, la creación de neuronas y la formación de conexiones entre neuronas.
Esos resultados sugerían que las células progenitoras del Alzheimer se convertirían en neuronas maduras mucho antes que sus homólogas sanas y, de hecho, eso es lo que observaron los investigadores en placas de laboratorio.
"Las células se diferencian 'mejor', o al menos más rápido", dijo Yankner. "Se obtienen más neuronas, no menos".
Las células derivadas del Alzheimer también se volvieron eléctricamente excitables, es decir, capaces de comunicarse entre sí, antes y con más vigor que las células de control.
Formular preguntas a REST
Yankner buscó respuestas en una proteína llamada REST. La proteína tenía un interés especial por dos razones: porque se sabe que regula la diferenciación neuronal durante el desarrollo temprano y porque Yankner había demostrado anteriormente que, después de disminuir en la primera infancia, REST resurge en el cerebro envejecido y puede llegar a ser un factor de diferenciación neuronal. protegen contra la neurodegeneración y otros tipos de estrés.
Efectivamente, las células de Alzheimer prematuramente diferenciadas tenían menos REST en sus núcleos que las células normales. El REST que quedaba no se unía a los genes ni funcionaba con normalidad.
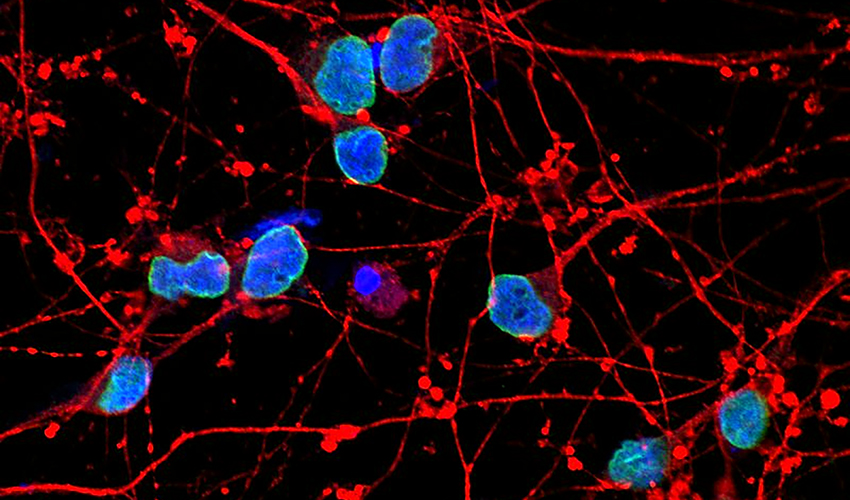
Los investigadores también descubrieron que los núcleos de las células de Alzheimer estaban deformados con más frecuencia y presentaban un mayor número de cambios estructurales en sus membranas que las células normales. Investigaciones anteriores habían detectado defectos de este tipo en cerebros de personas fallecidas por Alzheimer, pero hasta ahora no estaba claro si estaban relacionados con la neurodegeneración y de qué forma.
Los investigadores se preguntaron si la constelación de anomalías -desde la actividad génica hasta la diferenciación prematura, pasando por la baja REST y los defectos del núcleo celular- podría estar alimentada por la beta amiloide tóxica, la proteína famosamente implicada en el desarrollo del Alzheimer. Sin embargo, cuando los investigadores interrumpieron la producción de la proteína amiloide, nada cambió.
¿Y qué hay de la tau fosforilada, base de los llamados ovillos neurofibrilares que se encuentran en los cerebros de los enfermos de Alzheimer? La respuesta, una vez más, fue negativa: los cambios se produjeron antes de que apareciera cualquier tau anormal en las células.
Comprobación de la realidad
Las divergencias entre las células de Alzheimer esporádico y las células normales eran tan sorprendentes que los investigadores se preguntaron si no habrían cometido un error al reprogramar las células madre.
"Al principio, era escéptico de que pudiera haber un defecto tan profundo en el Alzheimer esporádico, en el que no hay una mutación genética dominante", afirma Yankner.
Pero gracias a la colaboración con colegas de varias instituciones, los investigadores pudieron replicar sus hallazgos en células iPS normales y esporádicas de Alzheimer obtenidas de otros tres laboratorios; en células madre editadas para tener la APOE4el factor de riesgo genético más común del Alzheimer; y en organoides cerebrales, pequeñas estructuras parecidas al cerebro hechas de células iPS cultivadas en andamios 3D.
Los estudios de perfiles genómicos sugirieron que REST era el regulador génico con más probabilidades de estar alterado en los organoides con la APOE4 mutación, seguida de otras dos proteínas que interactúan con REST.
Según Yankner, los organoides son una tecnología apasionante para estudiar los acontecimientos tempranos del neurodesarrollo.
Coautor del estudio George Churchcatedrático de Genética Robert Winthrop en el Instituto Blavatnik del HMS, está entusiasmado con el potencial de esta tecnología para descubrir más rápidamente los factores que contribuyen a enfermedades que no tienen causas genéticas claras y que tardan más de medio siglo en manifestarse en los seres humanos.
"No sólo podemos crear tipos celulares humanos adecuados, sino incluso saltarnos las muchas décadas que normalmente se necesitan para desarrollar un fenotipo y encontrar ensayos que detecten la predisposición a enfermedades de aparición tardía incluso cuando la genética conocida es inadecuada", afirmó.
Juventud y edad
El estudio plantea dos puntos contraintuitivos: en primer lugar, que los orígenes de una enfermedad que afecta a los adultos mayores pueden estar enraizados en el desarrollo temprano y, en segundo lugar, que las células cerebrales derivadas de pacientes con neurodegeneración se desarrollan más rápido, no más despacio, que las células normales.
Yankner se pregunta si la rápida maduración de las neuronas en los enfermos de Alzheimer hace que su reserva de células madre neuronales se agote en la vida adulta antes que en las personas que no padecen neurodegeneración. Otra posibilidad es que la diferenciación acelerada de las células madre neuronales afecte a la recuperación de la memoria en la edad adulta al alterar los circuitos neuronales establecidos, afirma.
También es posible, según Yankner, que los fenómenos observados por su equipo no causen directamente el Alzheimer, sino que lo anuncien. De ser así, estos cambios podrían servir como marcadores precoces de la enfermedad, como una oportunidad para intervenir antes de que aparezcan los síntomas y como una forma más fácil y rápida de detectar nuevos tratamientos.
Otros estudios abordarán estas y otras cuestiones.
Aunque el nuevo modelo representa un gran paso adelante en la investigación del Alzheimer, es poco probable que constituya el capítulo final de la historia.
"Estos modelos de cultivo de células iPS son valiosos porque derivan de células humanas y reproducen la cinta del desarrollo. Sin embargo, no han envejecido 80 años como un cerebro con Alzheimer", afirma Yankner.
No obstante, añadió, este nuevo recurso ya ha empezado a espolear un aluvión de nuevas investigaciones que, espera, profundizarán nuestra comprensión de una enfermedad compleja y, en última instancia, mejorarán vidas.
Financiación y autoría
Katharina Meyer, becaria posdoctoral del laboratorio de Yankner, y Heather Feldman, antigua estudiante de posgrado del laboratorio de Yankner que ahora trabaja en el Centro de Investigación Oncológica Fred Hutchinson de Seattle, son coautoras del artículo. Otros autores pertenecen al HMS, al Instituto Wyss de Ingeniería Biológica, a la Universidad Putra de Malasia y al Instituto Picower de Aprendizaje y Memoria del MIT.
Este trabajo ha sido financiado por los Institutos Nacionales de Salud (becas DP1OD006849, R01AG046174, RF1AG048056, R01AG046174, RF1AG048029 y RM1HG008525), la Fundación Paul F. Glenn para la Investigación Médica, la Iniciativa de Investigación Fidelity Biosciences, la Fundación de la Familia Robert A. y Renee E. Belfer y el Fondo Cure Alzheimer.
Fuente: https://hms.harvard.edu/news/sporadic-alzheimers-dish


Añadir un comentario